基本信息
- 作品名称:
- 人血管内皮细胞生长抑制因子(VEGI)的结构与功能学初步研究
- 大类:
- 自然科学类学术论文
- 小类:
- 生命科学
- 简介:
本课题探讨血管内皮生长抑制因子(VEGI-192)的结构和功能学关系,首次发现VEGI-192蛋白具有形成多聚体空间结构的特性;通过体内、体外抗血管新生实验,证明了VEGI-192蛋白多聚体的结构形式可能为其生物学活性形式;同时以整合素αvβ3为肿瘤靶点,RGD-4C肽为肿瘤靶向载体,VEGI-192蛋白为抗肿瘤效应分子,成功构建靶向性抗肿瘤融合蛋白RGD-VEGI-192。
- 详细介绍:
本课题组成员自2008年开始研究一种更加高效稳定的蛋白表达系统和纯化复性方法,目前已成功建立VEGI-192蛋白的新型自动诱导原核表达系统及蛋白制备新工艺,并能高效稳定地表达高产量、高纯度、高活性及可溶性好的VEGI-192重组蛋白。因为本系统自身的独特设计,可以为重组蛋白在宿主菌中提供均衡氧化还原势能,以利于蛋白的正确空间折叠,应用该自动诱导系统表达的VEGI-192重组蛋白在产量、可溶性、活性等方面均明显优于传统IPTG诱导表达系统。而在蛋白纯化过程中,通过Western blotting检测方法比较两个系统获得的VEGI-192重组蛋白条带的异同,我们发现自诱导系统存在的丰富的多聚体形态,于是,我们提出一个假设:VEGI-192蛋白具有形成多聚体空间结构的特性,并且研究证明这种多聚体的结构形式可能为其生物学活性形式。
我们发现,进行非还原SDS-PAGE后再进行Western Blotting检测来进一步分析鉴定自诱导表达系统纯化的VEGI-192蛋白,有两条蛋白条带清晰可见,我们推测这很可能便是VEGI-192的多聚体条带。为了进一步验证排除非特异条带的可能性,我们充分煮沸使VEGI-192变性后再次进行Western Blotting分析,结果显示无多聚体蛋白条带,这从一方面面证明了VEGI-192存在多聚体的结构形式。同时,我们将VEGI-192用非还原SDS-PAGE后再进行考马斯亮蓝染色,切下处于上方的多聚体条带作质谱分析,结果显示该条带即为VEGI-192蛋白,这充分证明了VEGI-192存在多聚体的结构形式。目前我们正开展对VEGI-192蛋白的结晶实验,拟进行X-射线晶体衍射实验对其多聚体结构进行更为详尽的鉴定。
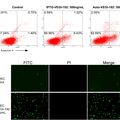
我们发现了自诱导系统制备的重组蛋白的多聚体量更多,进而通过采用MTT比色试验法和Annexin V细胞染色分析结合流式细胞术检测VEGI-192重组蛋白在不同多聚体形态下的体外抑制内皮细胞增殖及诱导细胞凋亡的生物学活性。同时应用鸡胚绒毛尿囊血管新生抑制实验测定两者体内抑制血管新生活性,我们发现多聚体含量越高的VEGI-192重组蛋白其抗血管新生的生物学活性更强。这充分证明VEGI-192蛋白形成的多聚体的空间结构可能为其生物学活性形式。
同时在VEGI-192蛋白的结构改造与修饰方面,我们引入RGD多肽与VEGI-192形成嵌合蛋白,拟探讨RGD的嵌合改造是否能增强VEGI-192的功效。RGD肽是一类含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp)的短肽,作为整合素和其配体相互作用的识别位点, 介导细胞与细胞外基质及细胞之间的相互作用。肿瘤细胞或者新生血管可以特异表达某些整合素如αvβ3,能以一定的亲和力结合RGD肽,成为肿瘤治疗的新靶点。因此,RGD 肽在肿瘤治疗中的应用已成为研究热点。RGD肽可以诱导肿瘤细胞凋亡而且作为载体在肿瘤靶向治疗中发挥重要作用。而目前在VEGI蛋白的三维立体结构、作用机理和药理学性质没有完整清晰的了解的情况下,我们拟构建靶向性更强的嵌合重组蛋白RGD-VEGI-192,以整合素αvβ3为肿瘤靶点,RGD-4C肽为肿瘤靶向载体,VEGI-192蛋白为抗肿瘤效应分子,构建靶向性抗肿瘤融合蛋白RGD-VEGI-192,并检测其生物学活性,为深入探讨RGD-VEGI-192的体内靶向抑瘤活性及肿瘤治疗应用前景奠定基础。同时丰富了VEGI-192在肿瘤治疗中的应用形式,为肿瘤靶向治疗提供了新思路。
- 获奖情况:
第十二届“挑战杯”作品 一等奖
1.本论文部分结果已发表于SCI杂志《Protein Science》,影响因子2.9,本课题组成员刘汉凝同学为共同第一作者。
2.本课题组构建的VEGI-192蛋白的新型自动诱导原核表达系统及蛋白制备新工艺的专利申请已获国家知识产权局予以受理,申请号为200910037702.6。
3.本课题组构建的靶向性抗肿瘤融合蛋白RGD-VEGI-192表达克隆专利申请已获国家知识产权局予以受理,申请号为200910037701.1。
4.本作品获我校第十一届“挑战杯”大学生课外学术作品大赛一等奖。
5.本作品获广东省第十一届“挑战杯”大学生课外学术作品大赛特等奖。