基本信息
- 作品名称:
- 给予肿瘤标志物的新型免疫传感器的构建
- 大类:
- 科技发明制作A类
- 小类:
- 生命科学
- 简介:
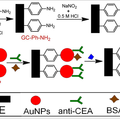
在电化学免疫传感器的构建中免疫传感界面的长期稳定性是一个很重要的问题。本论文制备了一种新型稳定的癌胚抗原(CEA)电化学免疫传感器。该免疫传感器是由金纳米颗粒修饰玻碳电极所形成的传感界面(GC-Ph-AuNP)构建而得的。首先在玻碳电极上修士一层对苯二胺,然后金纳米颗粒通过碳金键被固定到玻碳电极表面。癌胚抗原的抗体(anti-CEA)通过吸附在金纳米颗粒表面从而被固定在玻碳电极上。本论文所制备的电化学免疫传感器的线性范围是10 fg 到 100 ng mL-1,检出限为3 fg mL-1 (信噪比=3)。该免疫传感器的响应电流在一个月内仅降低了4。本论文所制的免疫传感器展现了较高的灵敏性,较宽的线性范围,较低的检出限以及较好的选择性和稳定性。同时这种免疫传感界面的构建方式可以被广泛的应用在其他免疫传感器的构建中。
关键词:癌胚抗原;电化学免疫传感器;金纳米颗粒;碳金键
- 详细介绍:
疾病相关蛋白的精确及灵敏测定在临床诊断、生物利用和生物化学研究中是非常重要的(Lefkowitz et al., 2010; Dutsch-Wicherek, 2010)。特别是,肿瘤和传染性疾病相关蛋白的临床测定是能尽早发现肿瘤、癌症等疾病的高度可靠的诊断方法(Gunaseelan et al., 2010; Coyle and Johnston, 2010)。近年来免疫测定法由于其较好的选择性和较高的灵敏度已经在肿瘤标志物的定量检测和癌症筛查中得到了越来越多的关注(Gas et al., 2010; Bosker and Huestis, 2009)。目前我们已经形成了多种能够精确检测肿瘤标志物的免疫分析方法,包括化学发光免疫分析法,荧光免疫分析法,拉曼光谱免疫分析法,电化学免疫分析法和表面等离子体共振免疫分析法(Xu et al., 2011; Tang et al., 2010; Song et al., 2009; Chen et al., 2009; Bi et al., 2009; Dai et al., 2011)。其中电化学免疫分析法由于具有灵敏度高、检测限低,分析快速等优点而引起了广泛的关注(Wang et al., 2004; Centi et al., 2007; Zhang et al., 2010; Malhotra et al., 2010)。
由于纳米技术的迅猛发展,人们发现将纳米技术运用于电化学免疫传感器可以进一步改善电化学免疫传感器的性质(Ma et al., 2002; Wang et al., 2007; Li et al., 2006)。最近,报道了一系列的将金纳米材料应用于固定生物分子的文章(Liu et al., 2006; Wang et al., 2006a,b; Wang et al., 2008)。其中金颗纳米粒因其具有合成简便、比表面积大和吸附能力强等优势而受到人们的格外关注。金纳米颗粒良好的生物相容性和电子传导能力可以在电极表面提供一个温和的不受限制的微环境并促进表面生物分子和电极之间的电子传递,因而金纳米颗粒常作为一种膜修饰材料而被用于电化学免疫传感器的构建(Ma et al., 2002; Shi et al., 2011; Wang et al., 2011; Xu et al., 2010; Su et al., 2006)。然而,含有金纳米颗粒的修饰膜的长期稳定性是其进一步应用中一个亟待解决的问题。常见的固定金纳米颗粒方法有静电吸引法、包埋法以及利用化学键(S-Au、NH-Au键)的方法(Wang et al., 2003; Xu et al., 2007; Haryono et al., 2006; Shenhar et al., 2005; Pacifico et al., 2005; Tognarelli et al., 2005; Yamanoi et al., 2004)。这些方法存在着以下一些缺点:1)对基底物质的附着力不够(包埋法、S-Au、NH-Au键法);2)在特定的化学环境里不稳定(静电吸引法、包埋法);3)金纳米颗粒固定的多少及方向不可控(包埋法、S-Au、NH-Au键法)以及4)固定金纳米颗粒的用时太长(静电吸引法)(Wohltgen et al., 1998; Leibowitz et al., 1999; Templeton et al., 2000)。
本项工作中,研究出一种新型的含有被稳定固定到玻碳电极表面的金纳米颗粒的免疫传感界面(GC-Ph-AuNP),并以此免疫传感界面制备了用于癌胚抗原(CEA)检测的新型电化学免疫传感器。该传感器具有良好的稳定性及重现性、较广的线性范围(10 pg-100 ng mL−1)、较低的检出限(3 fg mL−1,信噪比=3)以及简单快速的制备方法。- 获奖情况:
北京市二等奖